REPLICACIÓN DE ADN
Una vez que se comprobó que el ADN era el material hereditario y se descifró su estructura, lo que quedaba era determinar cómo el ADN copiaba su información y cómo la misma se expresaba en el fenotipo. Matthew Meselson y Franklin W. Stahl diseñaron el experimento para determinar el método de la replicación del ADN. Tres modelos de replicación eran plausibles.
1. Replicación conservativa: durante la cual se produciría un ADN completamente nuevo durante la replicación.
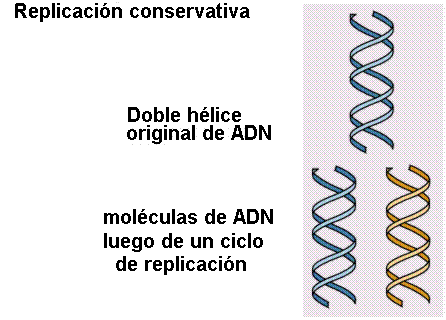
2. En la replicación semiconservativa se originan dos moléculas de ADN, cada una de ellas compuesta de una hebra del ADN original y de una hebra complementaria nueva. En otras palabras, el ADN se forma de una hebra vieja y otra nueva. Es decir que las hebras existentes sirven de molde complementario a las nuevas.
![]()
3. La replicación dispersiva implicaría la ruptura de las hebras de origen durante la replicación que, de alguna manera, se reordenarían en una molécula con una mezcla de fragmentos nuevos y viejos en cada hebra de ADN.

El experimento de Meselson-Stahl consiste en cultivar la bacteria Escherichia coli en un medio que contenga nitrógeno pesado (15Nitrógeno, que es más pesado que el isótopo más común: el 14Nitrógeno). La primera generación de bacterias se hizo crecer en un medio que únicamente contenía 15Nitrógeno como fuente de N. La bacteria se transfirió luego a un medio con 14N. Watson y Crick habían pronosticado que la replicación del ADN era semiconservativa; de ser así, el ADN extraído de las bacterias luego de cultivarlas por una generación en 14N tendría un peso intermedio entre el ADN extraído del medio con 15N y el del extraído de medio con 14N, y así fue.
Los detalles del experimento, que incluye un proceso de ultracentrifugación en cloruro de Cesio (CeCl2), puede encontrarse en el Curtis.
La replicación del ADN, que ocurre una sola vez en cada generación celular, necesita de muchos «ladrillos», enzimas y una gran cantidad de energía en forma de ATP (recuerde que luego de la fase S del ciclo celular, las células pasan a una fase G a fin de, entre otras cosas, recuperar energía para la siguiente fase de la división celular). La replicación del ADN en el ser humano ocurre a una velocidad de 50 nucleótidos por segundo; en procariotas, a 500/segundo. Los nucleótidos tienen que ser armados y estar disponibles en el núcleo conjuntamente con la energía para unirlos.
La iniciación de la replicación siempre acontece en un cierto grupo de nucleótidos, el origen de la replicación, requiere, entre otras, de las enzimas helicasas para romper los puentes hidrógeno y las topoisomerasas para aliviar la tensión y de las proteínas de unión a cadena simple para mantener separadas las cadenas abiertas.
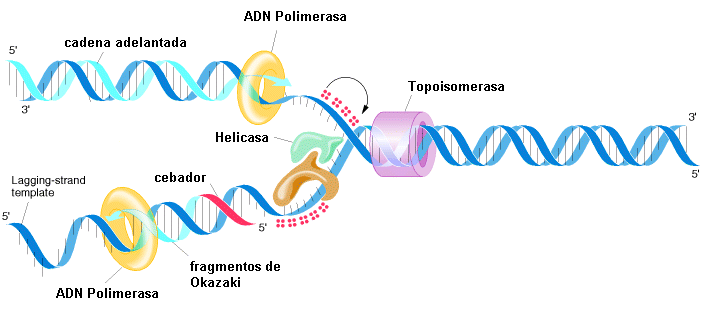
Una vez que se abre la molécula, se forma un área conocida como «burbuja de replicación»; en ella se encuentran las «horquillas de replicación». Por acción de la ADN polimerasa, los nuevos nucleótidos entran en la horquilla y se enlazan con el nucleótido correspondiente de la cadena de origen (A con T, C con G). Los procariotas abren una sola burbuja de replicación, mientras que los eucariotas, múltiples. El ADN se replica en toda su longitud por confluencia de las «burbujas».
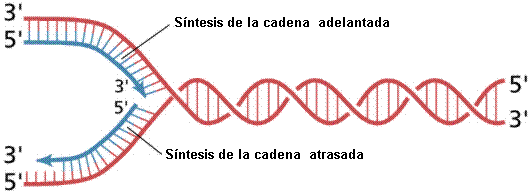
Dado que las cadenas del ADN son antiparalelas, y que la replicación procede solo en la dirección 5′ a 3′ en ambas cadenas, numerosos experimentos mostraron que una cadena formará una copia continua, mientras que en la otra se formarán una serie de fragmentos cortos conocidos como fragmentos de Okazaki. La cadena que se sintetiza de manera continua se conoce como cadena adelantada y la que se sintetiza en fragmentos, cadena atrasada.
Para que trabaje la ADN polimerasa, es necesaria la presencia, en el inicio de cada nuevo fragmento, de pequeñas unidades de ARN conocidas como cebadores; a posteriori, cuando la polimerasa toca el extremo 5′ de un cebador, se activan otras enzimas, que remueven los fragmentos de ARN, colocan nucleótidos de ADN en su lugar y una ADN ligasa los une a la cadena en crecimiento.
MUTACIONES
• Mutaciones génicas
Son las verdaderas mutaciones, porque se produce un cambio en la estructura del ADN. A pesar de todos los sistemas destinados a prevenir y corregir los posibles errores, estos pueden ser las mutaciones puntuales, que son el cambio de una de las bases de un par en el ADN; un cambio en una base nitrogenada puede alterar la estructura completa de la proteína.
Tirosina arginina metionina
AUG GCU UAC
Tirosina glutamina metionina
AUG GUU UAC
De vez en cuando se produce alguno en la réplica, bien por colocarse una Citosina (C) en lugar de una Timina (T), o una Adenina (A) en lugar de una Guanina (G); o bien porque el mecanismo de replicación se «salta» algunas bases y aparece una «mella» en la copia. O se unen dos bases de Timina, formando un dímero.
Aunque se trate de un cambio de un nucleótido por otro, supondrá una alteración en la secuencia de un gen, que se traduce posteriormente en una modificación de la secuencia de aminoácidos de una proteína.
Al transcribirse la mutación, al menos un triplete del ARNm se encuentra modificado y su traducción da lugar a que se incorpore un aminoácido distinto del normal en la cadena polipeptídica. Es un cambio que, aunque la mayoría de las veces va a ser perjudicial, en contadas ocasiones puede provocar que mejore un gen y, gracias a esta característica, se sintetice una proteína distinta, que tenga propiedades distintas o participe en la formación de estructuras más eficaces.
En estos casos raros, pero esenciales para la evolución de las especies, los individuos portadores de la mutación poseen ventajas adaptativas respecto a sus congéneres, por lo que el gen mutado es posible que con el tiempo, y gracias a la selección natural, sustituya al gen original en la mayoría de los individuos que componen la población.
• Mutaciones cromosómicas
La sustitución de un nucleótido por otro no es el único tipo posible de mutación. Algunas veces se puede ganar o perder por completo un nucleótido. Además, es posible que se produzcan modificaciones más obvias o graves, o que se altere la propia forma y el número de los cromosomas. Una parte del cromosoma se puede separar, invertir y después unirse de nuevo al cromosoma en el mismo lugar. A esto se le llama inversión. Si el fragmento separado se une a un cromosoma distinto, o a un fragmento diferente del cromosoma original, el fenómeno se denomina translocación. Algunas veces se pierde un fragmento de un cromosoma que forma parte de una pareja de cromosomas homólogos, y este fragmento es adquirido por el otro. Entonces, se dice que uno presenta una deleción o deficiencia (dependiendo si el fragmento que se pierde es intersticial o terminal, respectivamente) y el otro, una duplicación. Por lo general, las deficiencias o deleciones son letales en la condición homocigótica, y con frecuencia las duplicaciones también lo son. Las inversiones y las translocaciones suelen ser más viables, aunque pueden asociarse con mutaciones en los genes cerca de los puntos donde los cromosomas se han roto. Es probable que la mayoría de estos reordenamientos cromosómicos sean la consecuencia de errores en el proceso de sobrecruzamiento.
• Causas de las mutaciones
En 1929, el biólogo estadounidense Hermann Joseph Muller observó que la tasa de mutaciones aumentaba mucho con los rayos X. Más tarde, se vio que otras formas de radiación, así como las temperaturas elevadas y varios compuestos químicos, podían inducir mutaciones; con frecuencia, las mutaciones resultan en la esterilidad o en la carencia de desarrollo normal de un organismo.
Si las mutaciones ocurren en los gametos humanos, pueden causar defectos de nacimiento. Si ocurren en las células somáticas, pueden desencadenar un cáncer. La tasa también se incrementa por la presencia de alelos específicos de ciertos genes, conocidos como genes mutadores, algunos de los cuales parece ser que producen defectos en los mecanismos responsables de la fidelidad de la replicación de ADN.
TERAPIA GÉNICA
La terapia génica es el proceso por el cual se inserta material genético en una célula, con el fin de hacer que esta produzca una proteína normal. Las utilidades van desde curar enfermedades unigénicas hasta modificar el equilibrio del sistema inmune, permitiendo la modulación de la respuesta contra cualquier antígeno. En esencia, es cambiar la secuencia del genotipo de un organismo para que tenga implicaciones fenotípicas.
Desde el descubrimiento de las enzimas de restricción en el año de 1970 por Arber y Hamilton, se sentaron las bases para transferir genes entre diferentes células u organismos, inclusive pertenecientes a diferentes especies. En 1978, se realizó la primera hormona recombinante insertando el gen de la insulina en una bacteria E. coli. De allí en adelante, se afianzaron los conocimientos necesarios para transferir genes a células humanas con el fin de alterar el fenotipo patológico y generar una nueva forma terapéutica. La primera transferencia se realizó en el año de 1989 en un paciente con una inmunodeficiencia. Aunque no se encontraron efectos clínicos, se explicitó que tampoco había efectos deletéreos, como muchos apocalípticamente habían pronosticado. En 1990, se trató con terapia génica un paciente que padecía de la deficiencia de la enzima adenosina-deaminasa, presentando infecciones bacterianas a repetición. Aunque la mejoría fue temporal, con este ensayo se comprobó que la terapia génica tenía posibilidades terapéuticas reales.
• Consideraciones generales
La terapia génica es un método que puede ser usado para el manejo de trastornos hereditarios, así como de enfermedades adquiridas. En las de origen puramente genético, están todas las alteraciones unigénicas, principalmente las que presentan un mecanismo de herencia recesivo, en donde se ha demostrado la relación entre un gen y una proteína. Las patologías adquiridas como neoplasias o enfermedades infecciosas tienen un abordaje curativo y otro preventivo, ya que si pudiéramos cambiar la susceptibilidad genética de un individuo a una cierta patología, podríamos prevenir la aparición de ese fenotipo y estaríamos “vacunando” a las personas contra padecimientos multifactoriales.
• Metodología
Para introducir un gen en una célula eucariote, se utilizan vectores que transportan normalmente material genético a las células, como virus o fagos. El ADN o ARN de estos organismos es cortado con enzimas de restricción con el fin de quitar las regiones patógenas e insertar en estas zonas de su genoma el gen de interés médico. Una vez recombinado el genoma del vector con el nuevo material genético, este se ensambla de forma fisiológica y se le deja “infectar” o transfectar la célula blanco. El vector, al realizar sus procesos de incorporación al genoma humano y a sus mecanismos de transcripción y traducción de proteínas, terminará finalmente generando cantidades importantes de la proteína normal que seguramente va a tener efectos terapéuticos en el paciente.
• Clasificación
La terapia génica se divide, según la metodología utilizada, en terapia In vivo o Ex vivo. En la primera, se realiza la transfección del material genético directamente a las células del tejido del paciente. Un ejemplo de este sistema es infectar, por inhalaciones con virus modificado, la mucosa respiratoria de los pacientes con fibrosis quística. La segunda estrategia, muy utilizada para el tejido hematopoyético, se trata de extraer parte de las células afectadas del paciente para realizar la modificación en el laboratorio y, posteriormente, introducir este tejido modificado (“curado”) nuevamente en el paciente. Otra forma de clasificar la terapia génica es utilizando el tipo de célula blanco: germinal o somática. La terapia sobre células germinales ha sido ampliamente rechazada en vista de que estaríamos influyendo sobre individuos aún no nacidos y sin los conocimientos suficientes para comprender las posibles implicaciones deletéreas que se podrían producir en un genoma pluripotencial.
• Vectores
Los vectores que transportan material genético dentro de las células son de tipo viral o no viral. En los primeros, se ha trabajado principalmente con adenovirus, herpes virus y retrovirus. Estos son modificados para disminuir su capacidad replicativa, haciéndolos inocuos para la célula. Los métodos no virales incluyen transporte del ADN en liposomas, electroporación, inyecciones de ADN desnudo o bombardeo con partículas de oro.
• Usos
En la actualidad, la terapia génica se utiliza para el tratamiento de enfermedades unigénicas, cáncer, enfermedades infecciosas y otras como la esclerosis lateral amiotrófica, la artritis reumatoide o la diabetes mellitus. La mayoría de esfuerzos se han dirigido hacia patologías del tejido hematopoyético o neoplasias. Las neoplasias dependientes de tejido nervioso son unas de las más promisorias para su curación, ya que las células son infectadas con virus que generan muerte celular solo en las zonas donde el vector se incorpora y, por lo tanto, las células normales de tejido nervioso no se verán afectadas por el tratamiento.
• Limitaciones
El principal obstáculo que afronta la terapia génica es la imposibilidad técnica de introducir el material genético en el mismo sitio donde están los genes anómalos. La mayoría de vectores deja los nuevos genes extracromosómicos, por lo que el efecto se pierde rápidamente por digestión del ADN o porque en las mitosis sucesivas el nuevo material no se incorpora a los cromosomas. La farmacocinética de los vectores virales o no virales es un elemento importante para un adecuado tratamiento y, hasta ahora, se han empezado a hacer las primeras consideraciones sobre la mejor manera de abordar el problema. En la mayoría de trabajos realizados hasta ahora, la limitación principal es el corto tiempo de expresión de la proteína nueva. Por múltiples razones, la célula termina evitando la transcripción y traducción del gen modificado y el efecto terapéutico desaparece. Otros efectos secundarios que se han visto son la reacción inmune contra el nuevo producto o la activación de otros sistemas génicos que, por ignorancia en la fisiología de la genética, es imposible prever su disregulación.
• Actualidad
En el momento actual, se han descrito en la literatura 425 protocolos para realizar terapia génica en humanos y se han intervenido más de 3400 pacientes en el mundo. El 70 % de las terapias realizadas han sido para intervenir procesos neoplásicos, un 12 % sobre enfermedades infecciosas y un 9 % sobre patologías unigénicas. Los métodos más utilizados como vectores son el retrovirus, los liposomas y los adenovirus.
• Conclusiones
La terapia génica se erige en la actualidad médica como una de las formas más promisorias de terapéutica, pero todavía hace falta encontrar la respuesta a muchos interrogantes conceptuales y técnicos para que esta sea un arma útil contra la amplia gama de patologías que enfrentamos los seres humanos. Los avances en genoma humano y en regulación génica seguramente van a traer los elementos necesarios para hacer de la terapia génica la nueva forma de manejar la salud en el mundo.
